Come creare nuovi antibiotici contro Helicobacter pylori

Sviluppare nuovi antibiotici contro Helicobacter pylori – un batterio patogeno che si annida nello stomaco di una persona su due – convincendo le cellule a produrre autonomamente gli ingredienti da testare. È il risultato di uno studio messo a punto da un gruppo di ricerca del Dipartimento di Farmacia e Biotecnologie dell’Università di Bologna.
La ricerca – pubblicata su Biochimica et Biophysica Acta – delinea un metodo inedito che, utilizzando batteri ingegnerizzati in laboratorio, permette di valutare “dall’interno” la possibilità di bloccare uno specifico meccanismo così da combattere la patogenicità di Helicobacter pylori.
NUOVI ANTIBIOTICI PER HELICOBACTER PYLORI
Helicobacter pylori è un batterio spiraliforme estremamente diffuso (si stima che circa il 50% della popolazione mondiale ne sia portatore) in grado di colonizzare la mucosa gastrica, ovvero il rivestimento interno del nostro stomaco. Nella maggior parte dei casi, l’infezione risulta asintomatica, ma una persona infetta su cinque finisce invece per sviluppare sintomi importanti, come ulcera e gastrite cronica. Inoltre, la sua presenza corrisponde ad una maggiore probabilità di sviluppare un tumore gastrico, una delle principali cause di morte al mondo tra le patologie oncologiche.
Numeri, questi, che rendono evidente la necessità di trovare nuovi farmaci in grado di combattere Helicobacter pylori, soprattutto perché sempre più ceppi del batterio sono ormai in grado di sopravvivere alla terapia antibiotica tradizionale. “Secondo l’Organizzazione Mondiale della Sanità, la lotta contro Helicobacter pylori costituisce una priorità per la salute pubblica”, conferma Barbara Zambelli, ricercatrice dell’Università di Bologna che ha coordinato lo studio. “Sviluppare nuovi farmaci in grado di combattere questo batterio è oggi fondamentale”.
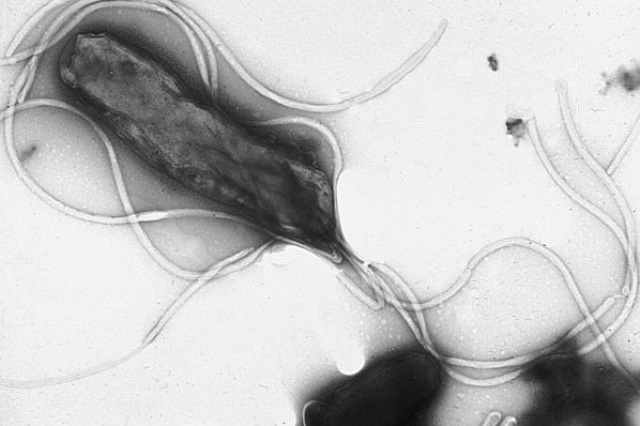
Helicobacter pylori visto al microscopio elettronico (Foto: Yutaka Tsutsumi)
IL RUOLO DELL'UREASI
Ma come riesce Helicobacter pylori a sopravvivere in un ambiente estremamente acido come quello dello stomaco umano? Il suo segreto si chiama ureasi: un enzima che utilizza il nickel come ione metallico e come tale è in grado di neutralizzare l’acido cloridrico contenuto nei succhi gastrici. E proprio qui si sono concentrati gli sforzi dei ricercatori: riuscire a bloccare l’attività di questo enzima significherebbe togliere al batterio il suo scudo protettivo.
L’idea non è nuova, ma i tentativi fatti finora in questa direzione non hanno prodotto grandi risultati. “Esistono molti inibitori dell’ureasi noti e studiati nel gruppo del prof. Stefano Ciurli, del Dipartimento di Farmacia e Biotecnologie”, spiega Barbara Zambelli. “La loro applicazione in ambito terapeutico, però, è stata sempre limitata, sia per gli effetti tossici che hanno sull’uomo, sia per la loro bassa capacità di azione all’interno dell’organismo”.
Per questo, il gruppo di ricerca dell’Alma Mater ha pensato ad un approccio alternativo. “La nostra idea – dice ancora Zambelli – era mettere a punto un meccanismo che, invece di interferire con l’attività dell’ureasi, agisca a monte, bloccando il processo utilizzato dal batterio per attivare l’ureasi stessa”.

BATTERI MODELLO
La soluzione individuata sta in un peptide – una piccola molecola formata da una sequenza di amminoacidi – in grado di interferire con la maturazione dell’ureasi. Per metterlo a punto e testarne l’efficacia, però, serviva un sistema affidabile che permettesse di superare la nota difficoltà dei peptidi di entrare all’interno del batterio, oltrepassando la membrana esterna, per agire sul meccanismo intracellulare. I ricercatori hanno così sviluppato un metodo che permette di sintetizzare i peptidi direttamente “dall’interno”, utilizzando batteri ingegnerizzati in laboratorio.
L’operazione si è svolta in due fasi e ha coinvolto un batterio chiamato Escherichia coli. "Si tratta di un batterio modello per la biologia molecolare”, spiega Barbara Zambelli. “La sua genetica è nota ed esistono molti strumenti che ci permettono di operare facilmente e rapidamente al suo interno, controllando quello che succede".
La prima azione da compiere, allora, era “travestire” Escherichia coli da Helicobacter pylori. Per questo, i ricercatori hanno clonato all’interno del batterio modello i geni che contengono le informazioni per lo sviluppo dell’ureasi e delle proteine necessarie alla sua maturazione. A questo punto, dopo aver verificato con successo la presenza dell’enzima attivo, è stata aggiunta al batterio un’ulteriore sequenza genica: quella collegata alla sintesi di un peptide capace di bloccare la formazione dell’ureasi.
Il risultato, insomma, è un sistema che permette di provare l’efficacia di queste molecole “convincendo” il batterio a crearle e dunque mettendole a contatto diretto con le altre funzioni del batterio stesso. Un processo che può rivelarsi particolarmente utile per lo sviluppo di nuovi antibiotici.
“Si tratta di un’idea innovativa nel campo della ricerca farmacologica”, conferma Zambelli. “La possibilità di testare gli inibitori dell’ureasi su un sistema cellulare che mima il batterio bersaglio aumenta la probabilità di ottenere farmaci efficaci”.
I PROTAGONISTI DELLO STUDIO
La ricerca è stata realizzata da un gruppo del Dipartimento di Farmacia e Biotecnologie dell’Università di Bologna – in particolare dalla collaborazione di Alberto Danielli, Stefano Ciurli e Barbara Zambelli – e ha coinvolto anche studenti di diversi corsi di Laurea e Dottorato tra cui la Laurea Magistrale in Biotecnologie Molecolari e Industriali. I risultati sono stati pubblicati su Biochimica et Biophysica Acta con il titolo “Targeting Helicobacter pylori urease activity and maturation: in-cell high-throughput approach for drug discovery”. Il lavoro è stato finanziato anche grazie ai fondi per il Finanziamento alla ricerca di base (FARB) dell’Università di Bologna.





